概念
系统
热力学系统由大量微观粒子组成的系统,与系统发生相互作用的外部环境称为外界
- 孤立系统:与外界没有物质和能量的交换
- 封闭系统:没有物质的交换,只有能量交换
- 开放系统:同时有物质和能量的交换
状态参量
分为宏观量和微观量
每个分子所具有的$v,m_p$为微观量
气体的宏观状态如$V,p$为宏观量
其中又分为广延量和强度量,如热量是广延量,温度是强度量
重要单位
热平衡
两者之间没有热量的交换,冷热程度不发生改变
平衡态
在经过足够长的时间后系统的状态参量不随时间改变,则称该系统达到了平衡态
弛豫时间
从初始状态到达到平衡态所需要的时间
若弛豫时间很短则可近似看作平衡态
准静态过程
过程足够缓慢以至于每一个中间态都可以看作平衡态
温标
温度的数值表示法
摄氏温标,用$t$表示,单位为$^\circ \text{C}$
热力学温标,用$T$表示,开尔文温标,单位为$\text{K}$
热力学定律
第零定律
若两个系统分别与第三个系统处于热平衡,则这两个系统必然也处于热平衡
第一定律
只要初末两个状态为平衡态
实际上对系统做功和传递热量是等效的,焦耳实验测出了热功当量
我们需要注意做功和传热是过程量和具体过程有关
内能的变化量是状态量只和始末状态有关(处于平衡态)
对于微小过程(准静态),有
闭口系统
上面的功定义为气体对外做的膨胀功$W$,则
用比表示也即
上面的式子适用于一切过程,不受过程性质和工质性质限制
对于可逆过程,上面有
开口系统
对于稳定流动,维持需要流动功和推动功
流动功不是工质本身的能量
所以对于开口系统,定义焓
和工质通过机轴对外输出的功$W_s$,和流速$c_f$,根据能量守恒
单位工质
技术功(工程上可以直接利用的功)
再进行变形,定义膨胀功$w$
技术功等于膨胀功减去净流动功
对于可逆过程,可以把技术功表示为
为与$p$轴围成的面积
理想气体
热容
可以看出热容的定义为
上面换成比热得到比热容
其中$C_m=cM$为摩尔热容,对于特殊过程,引入自由度
- $i=3$单原子分子
- $i=5$双原子分子
- $i=6$多原子分子
从而有定压热容和定容热容
从而有迈耶公式
$R$在数值上等于一摩尔理想气体等压过程升高$1\text{K}$对外做的功(克服外力膨胀)
定义比热容比
带入上面的关系得到
从定容推出的内能表达式适用于所有过程
物态方程
标准状态
这就是理想气体状态方程,$R=8.31$为摩尔气体常量
对方程进行变化,令
则得到了气体常数(只和气体种类有关,和状态无关)
再用比体积(单位质量)替代体积,得到
称为理想气体状态方程式(克拉贝龙方程式)
其中$k=R/N_A$称为玻尔兹曼常量,此式多用于计算分子数密度
带入标况可得
这个量被称为洛施密特常量
热力学过程
等体过程
等压过程
等温过程
其中摩尔定温热容
绝热过程
引入绝热指数(摩尔热容比)
得到绝热方程
在交点处,绝热过程的线更加陡
多方过程
做功把绝热过程中的$\gamma\to n$即可,注意
循环过程
某个状态出发经过一系列过程又回到初始状态的过程
顺时针为正,逆时针为负
正循环$W’>0$,逆循环相反
热机
吸热为$Q_1$,放热为$Q_2$
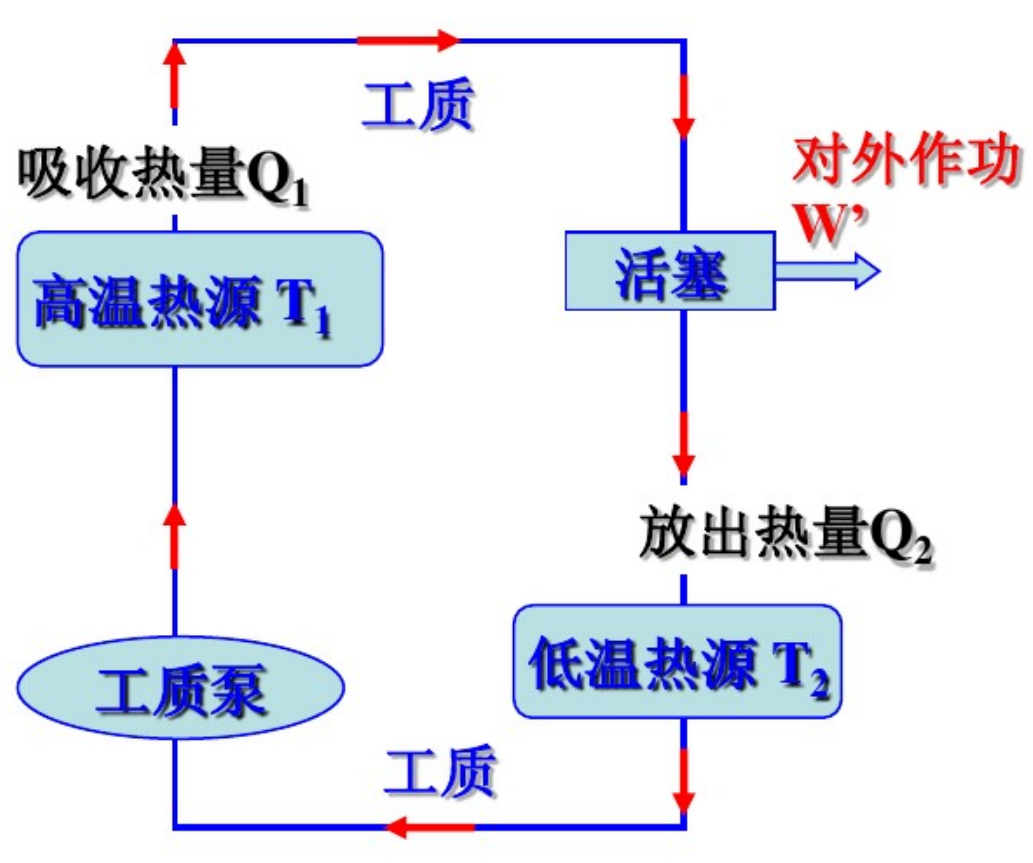
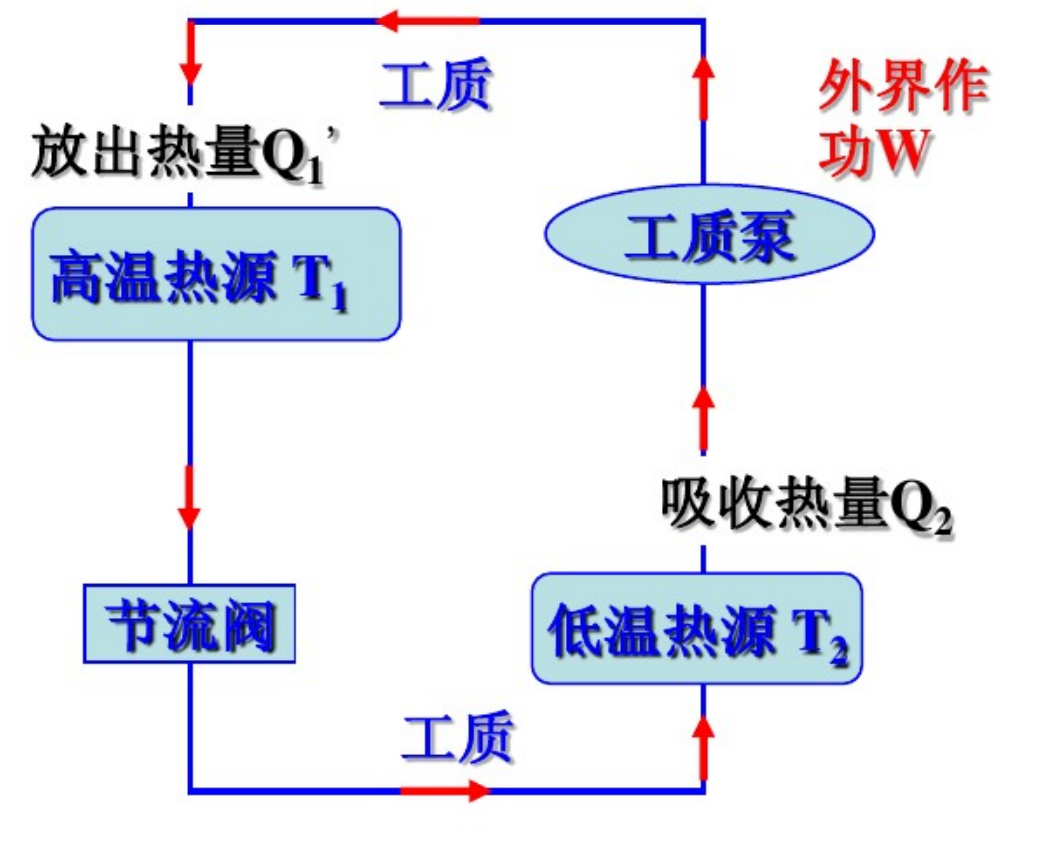
制冷机
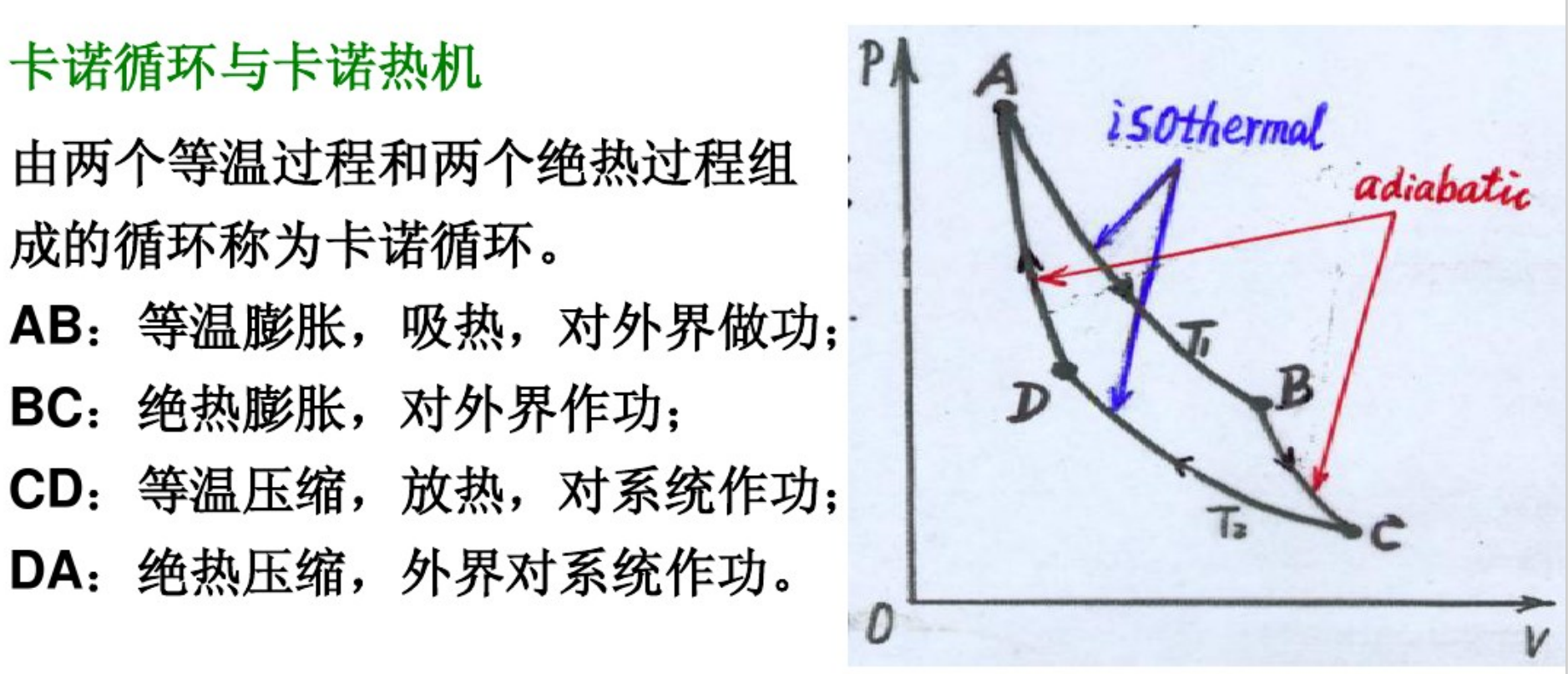
卡诺循环
气体动理论
分子与分子之间存在着一定的间距
分子之间存在着相互作用力,注意$r_0$
分子在不断的做无谓的运动,布朗运动
利用统计学方法来研究气体
分布
速率分布函数
只有积分是具有实际意义的,单个值不具有任何意义